Signalisation cellulaire par le NO : guanylate cyclase et NO-synthase

Personnel :
Isabelle Lamarre-Jouenne
Jean Christophe Lambry
Michel Négrerie
Thèmes de recherche :
Notre recherche concerne l’étude de l’allostérie dans les hémoprotéines impliquées dans la signalisation par le NO endogène (monoxyde d'azote) et leur régulation par des messagers cellulaires endogènes et par des activateurs et inhibiteurs exogènes. Ces études sont effectuées en corrélant les propriétés biochimiques de ces protéines avec leur dynamique moléculaire mesurée par spectroscopie optique résolue en temps. Dans ce contexte, nous étudions la guanylate cyclase (sGC), récepteur de NO chez l’homme, ainsi que des senseurs de NO bactériens et la NO-synthase pour corréler leurs propriétés au niveau physiologique à leur dynamique structurale au niveau fondamental.
La guanylate cyclase agit comme un relai dans la signalisation cellulaire : cette enzyme synthétise le second messager GMPc après activation par le NO endogène produit par la NO-synthase (NOS). La sGC humaine est impliquée dans de nombreux processus cellulaires (régulation de la pression artérielle, réponse immunitaire, apoptose, croissance tumorale…), y compris dans des états pathologiques tels que l’angiogenèse dans la croissance de tumeurs solides, tandis que les senseurs de NO bactériens (H-NOX), homologues au domaine senseur de la sGC, sont impliqués dans la formation des biofilms. Ces deux types de protéines sont des cibles pharmacologiques et leurs inhibiteurs constituent une source de médicaments potentiels.
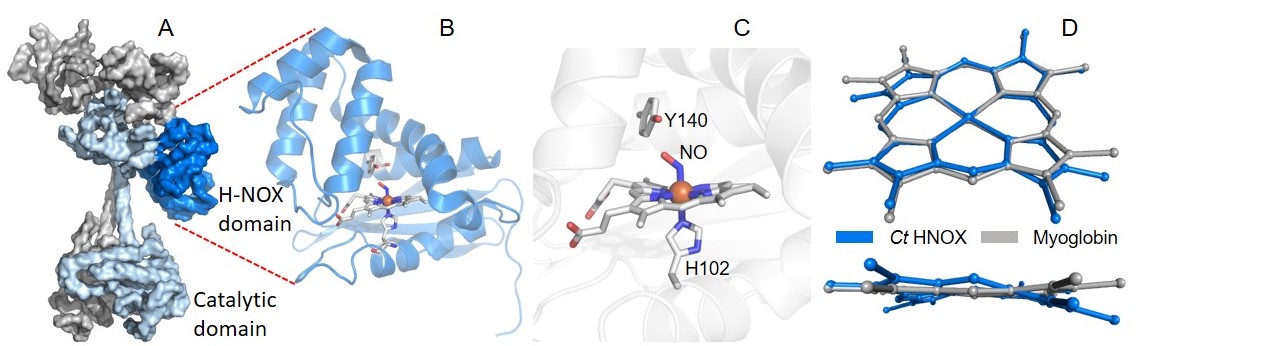
A : human guanylate cyclase. B : bacterial H-NOX domain. C : Heme pocket. D : distortion of the bacterial H-NOX heme upon NO binding compared with myoglobin.
Des mesures de l'activité enzymatique de la sGC et de la NOS sont effectuées en parallèle des mesures de spectroscopie transitoire. Réciproquement, les effets d'activateurs et d'inhibiteurs de ces deux protéines sur leur dynamique structurale sont évalués par absorption transitoire dans l'échelle de temps 1 ps - 1 s. Les mesures de spectroscopie résolue en temps sont initiées par la photo-dissociation du ligand diatomique de l'hème (NO, O2 ou CO), permettant de simuler la dissociation thermique physiologique.
Projets et résultats récents
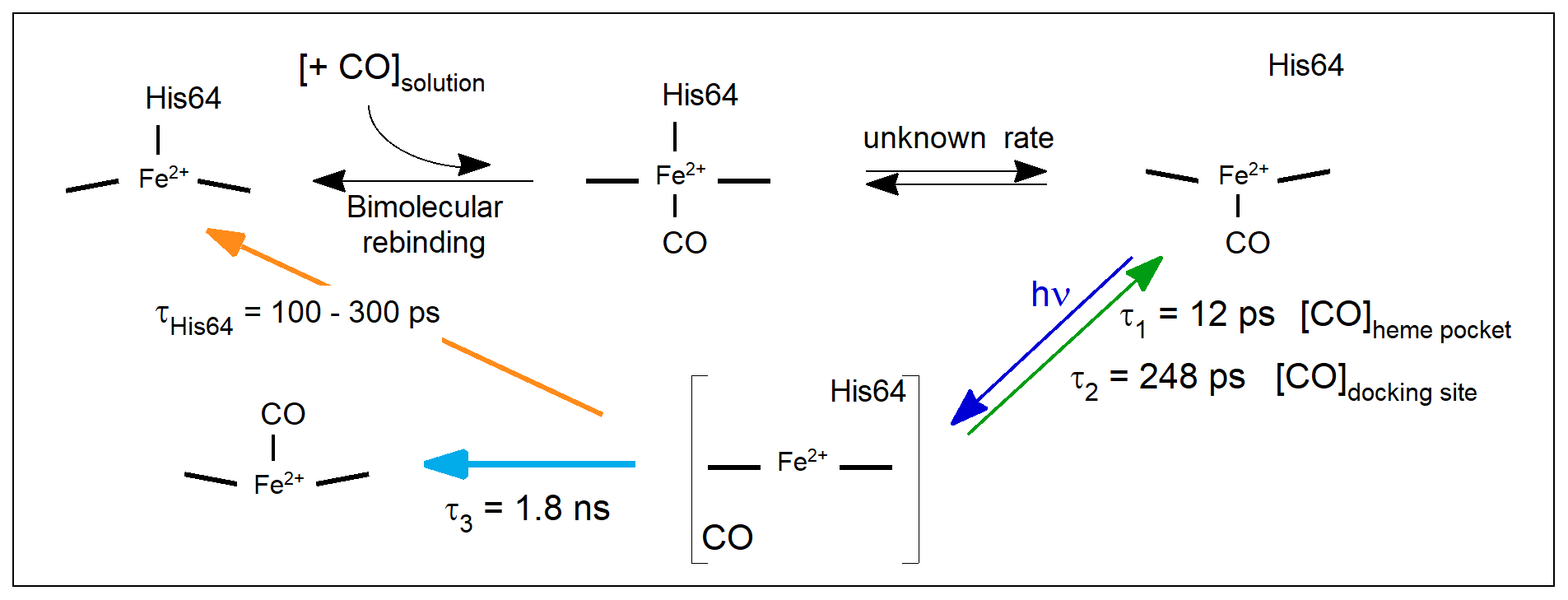
■ En utilisant un mutant de la myoglobine (H93C) nous avons démontré l'existence de l'état 5-coordonné du Fe de l'hème liant le CO malgré un effet "trans" positif, contrairement au NO, du fait de contraintes structurales dans la protéine. Cet état de coordination peut exister dans la guanylate cyclase en présence de CO et de stimulateurs (molécules artificielles). ► Protein Science (2024) 33, e5231. https://doi.org/10.1002/pro.5231
_________________________________________________________________________________________________________
■ Nous avons étudié la réactivité envers NO des senseurs H-NOX de trois espèces bactériennes par spectroscopie transitoire (1 ps – 5 ns). Les cinétiques et spectres associés montrent que les H-NOX modulent la dynamique du NO et la coordination de l’hème en fonction de la température mais dans des gammes différentes selon les espèces. L’affinité envers le NO est modifiée par changement de la probabilité de recombinaison avec l’hème. Ce mécanisme constitue un moyen d’adapter la réponse de l’hème aux changements d’environnement, liant la dynamique moléculaire fondamentale avec l’adaptation microbienne. ► Chemical Science (2023) 14, 8408. https://doi.org/10.1039/d3sc01685d
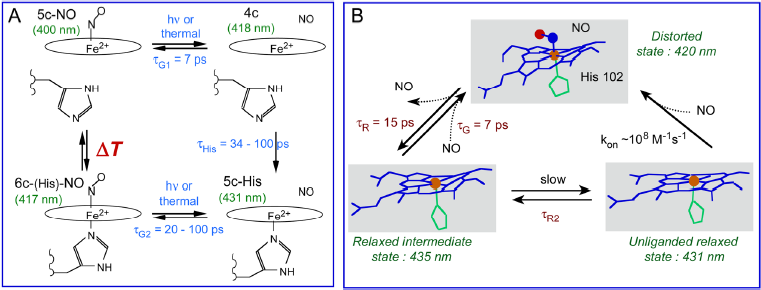
A : Modulation de l'état de coordination de l'hème 5c-NO ou 6c-His-NO en fonction de la température. ΔT dépend de l'espèce bactérienne. B : Relaxation de la distortion de l'hème pour H-NOX de l'espèce Caldanaerobacter tengcongensis.
_________________________________________________________________________________________________________
■ Le criblage d'une chimiothèque de composés naturels nous a permis de découvrir six inhibiteurs de la guanylate cyclase (dont l'hypéricine) extraits de plantes et lichens. Les concentrations effectives d'inhibition (IC50) sont de 0.2 à 1.5 µM pour la protéine purifiée. Ces molécules constituent des outils pour l'étude de l'angiogenèse tumorale dans laquelle la sGC est impliquée. ► J. Nat. Prod. (2020) 83, 3642. https://dx.doi.org/10.1021/acs.jnatprod.0c00854
Le mécanisme d'action de ces composés est en cours d'étude.

Collaborations :
Pr Colin Andrew, University of Oregon, La Grande, OR, USA : Dynamics and reactivity of cytochrome c'.
Pr Emil Martin, University of Texas Health Science Center in Houston, TX, USA : Regulation of guanylate cyclase.
Dr Byung-Kuk Yoo, Merck, Kenilworth, NJ, USA : Transient absorption spectroscopy of heme proteins.
Dr Pierre Nioche, Université Paris-Cité, Ecole de Médecine, Paris : Régulation des senseurs bactériens H-NOX.
Dr Serguei Kruglik, Université Paris-Cité, Ecole de Médecine, Paris : Spectroscopie Raman et pinces optiques.
Dr Julien Sellés, Institut de Biologie Physico-Chimique, UMR7141, Paris : Spectroscopie d'absorption transitoire de 10 ns à 1 s.
Publications récentes :
Controlling the trans effect induced by nitric oxide and carbon monoxide: H93C myoglobin versus H-NOX sensors and soluble guanylate cyclase.
B. K. Yoo, J. C. Lambry, M. Négrerie, Protein Science (2024) 33, e5231 https://doi.org/10.1002/pro.5231
Control of nitric oxide dynamics and interaction with substituted zinc-phthalocyanines.
N. Ben Brahim, S. Touaiti, J. Selles, J.-C. Lambry, M. Negrerie, Dalton Transactions (2024) 53, 772.
The H-NOX protein structure adapts to different mechanisms in sensors interacting with nitric oxide.
B. K. Yoo, S. G. Kruglik, M. Négrerie, Chemical Science (2023) 14, 8408. https://doi.org/10.1039/d3sc01685d
Ultrafast dynamics of heme distortion in the O2-sensor of a thermophilic anaerobe bacterium.
O. N. Petrova, B. K. Yoo, I. Lamarre, J. Selles, P. Nioche, M. Négrerie, Communication Chemistry (2021) 4, 31. https://doi.org/10.1038/s42004-021-00471-9
Soluble guanylate cyclase inhibitors discovered among natural compounds.
O. N. Petrova, I. Lamarre, F. Fasani, C. Grillon, M. Negrerie, J. Nat. Prod. (2020) 83, 3642−3651. https://dx.doi.org/10.1021/acs.jnatprod.0c00854
Raman tweezers microspectroscopy of functionalized 4.2-nm diameter CdSe nanocrystals in water reveals changed ligand vibrational modes by a metal cation.
R. Mrad, S.G. Kruglik, N. Ben Brahim, R. Ben Chaâbane, M. Negrerie, J. Phys. Chem. C (2019) 123, 24912−24918. https://dx.doi.org/10.1021/acs.jpcc.9b06756.
Iron transitions during activation of allosteric heme proteins in cell signaling.
M. Negrerie, Metallomics (2019) 11, 868−893. https://dx.doi.org/10.1039/C8MT00337H
Tailoring the photophysical properties and excitonic radiative decay of soluble CdSe quantum dots by controling the ratio of capping thiol ligand.
R. Mrad, M. Poggi, N. Ben Brahim, R. Ben Chaâbane, M. Negrerie, Materialia (2019) 5, 100191. https://dx.doi.org/10.1016/j.mtla.2018.100191
Structural changes and picosecond to second dynamics of cytochrome c in interaction with nitric oxide in ferrous and ferric redox states.
S. G. Kruglik, B.-K. Yoo, J.-C. Lambry, J.-L. Martin, M. Negrerie, Physical Chemistry Chemical Physics (2017) 19, 21317−21334.



