Le fonctionnement des protéines dépend de leur capacité à adopter des configurations distinctes de façon efficace. Nos recherches portent sur la dynamique interne associée à ces changements spécifiques, en particulier dans des protéines impliquées dans la catalyse enzymatique et la transduction du signal. Les changements les plus rapides et les plus spécifiques s'effectuent sur l'échelle des vibrations internes de la protéine. Ainsi, nous utilisons et nous développons des techniques de spectroscopie femtoseconde afin de sonder ces mouvements en temps réel. Nous tentons de comprendre la dynamique au niveau moléculaire de façon détaillée en combinant des études expérimentales et des simulations de dynamique moléculaire. Dans une partie important de nos projets actuels nous étudions, ou exploitons, le transfert de charges photoinduit dans les flavoprotéines. Ici, nous étudions le transfert fonctionnel de charges dans des chaînes composées de flavine et de résidues aromatiques, comme celles des cryptochromes et des photolyases, et nous utilisons la grande sensitivité de la cinétique de transfert d'électron de la configuration du paire donneur-accepteur comme sonde locale de la configuration. Récemment nous avons aussi découvert deux tout nouvelles réactions photochimiques au sein des flavoprotéines : la photooxidation des protéines semi-réduites et la photodissociation ultrarapides des interactions de transfert de charge entre la flavine et un inhibiteur. Nous visons à exploiter ces réactions pour créer des nouveaux photo-commutateurs et des nouveaux systèmes photocatalytiques basés sur des flavoprotéines. D’autres projets concernent des hémoprotéines, perturbées de façon impulsive par la dissociation d'un ligand à l'aide d'une impulsion lumineuse, et les photoproduits des complèxes Fer-Soufre.
Les projets actuels incluent la photocatalyse de la flavoenzyme Fatty Acid Photodecarboxylase (FAP) et le mécanisme et les applications possibles de photo-dissociation du complexe de transfert de charge entre la flavoproteine MSOX et son inhibiteur MTA. Ce dernier projet est financé par l’ANR (ANR PHOTOCT, 2024-2027), en collaboration avec l’IBS Grenoble (Martin WEIK) et l’ITODYS, Université Paris-Cité (Antonio MONARI), que nous coordonnons.
En grande partie, le développement de ces travaux s'effectue en synergie avec d'autres thèmes du laboratoire, en particulier "Mécanismes moléculaires adaptatifs dans des systèmes microbiens" et la "Spectroscopie et contrôle cohérents dans des systèmes biologiques ", ainsi que des collaborations externes.
Contact : marten.vos at polytechnique.edu
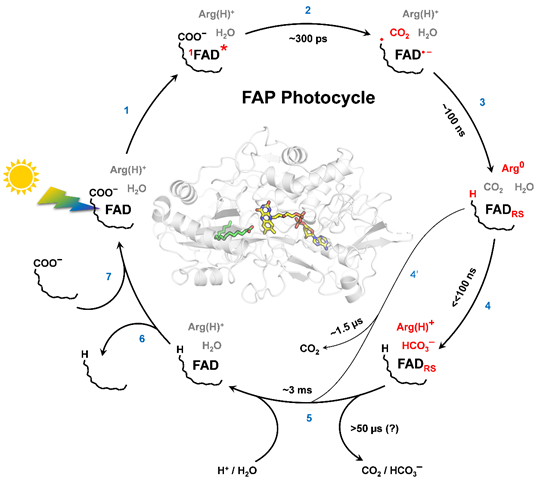
Photocycle de Fatty Acid Photodecarboxylase (FAP). Voire Sorigué, D. et al, (2021) Science 372, eabd5687
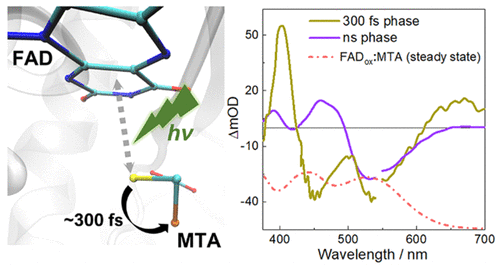
Photo-commutation dans le complexe MSOX-MTA. Voire Zhuang, B. & Vos, M.H. (2022) J. Am. Chem. Soc. 144, 11569-11573
Publications récentes selectionnées:
Zhuang, B., Ramodiharilafy, R., Aleksandrov, A., Liebl, U. & Vos, M.H. (2024) Mechanism of Ultrafast Flavin Photoreduction in the Active Site of Flavoenzyme LSD1 Histone Demethylase, Chem. Sci., sous presse
Aleksandrov, A., Bonvalet, A., Müller, P., Sorigué, D., Beisson, F., Antonucci, L., Solinas, X., Joffre, M. & Vos, M.H. (2024) Catalytic Mechanism of Fatty Acid Photodecarboxylase: on the Detection and Stability of the Initial Carbonyloxy Radical Intermediate, Ang. Chem. Int. Ed. 63, e202401376
Raics, K., Pirisi, K., Zhuang, B., Fekete, Z., Kis-Bicskei, N., Pecsi, I., Pozsonyi Ujfalusi, K., Telek, E., Li, Y., Tolentino Collado, J., Tonge, P.J., Meech, S.R., Vos,M.H., Bodis, E. & Lukacs, A. (2023) Accelerated electron transfer and increased enzymatic activity in genetically modified photoactivable adenylate cyclase OaPAC, J. Biol. Chem. 299, 105056
Zhuang, B., Aleksandrov, A. Seo, D. & Vos, M.H. (2023) Excited-State Properties of Fully Reduced Flavins in Ferredoxin-NADP+ Oxidoreductase, J. Phys. Chem. Lett. 14, 1086-1102
Diuba, A.V., Vygodina, T.V., Azarkina, N.V., Arutyunyan, A.M., Soulimane, T., Vos, M.H. & Konstantinov, A.A. (2023) Individual heme a and heme a3 contributions to the Soret absorption spectrum of the reduced bovine cytochrome c oxidase, Biochim. Biophys. Acta 1864, 148937
Vos, M.H., Salman, M. & Liebl,U. (2022) Early processes in heme-based CO-sensing proteins, Front. Mol. Biosci. 9, 1046412
Zhuang, B., Vos, M.H. & Aleksandrov, A. (2022) Photochemical and Molecular Dynamics Studies of Halide Binding in Flavoenzyme Glucose Oxidase, ChemBioChem 23, e202200227
Zhuang, B. & Vos, M.H. (2022) Photoswitching Behavior of Flavin–Inhibitor Complex in a Nonphotocatalytic Flavoenzyme, J. Am. Chem. Soc. 144, 11569-11573
Kapetanaki, S.M., Fekete, S., Dorlet, P., Vos, M.H., Liebl, U. & Lukacs, A. (2022) Molecular insights of the role of heme in the transcriptional regulatory system AppA/PpsR, Biophys. J. 121, 2135-2151
Zhuang, B., Liebl, U. & Vos, M.H. (2022) Flavoprotein photochemistry: fundamental processes and photocatalytic perspectives, J. Phys. Chem. B 126, 3199-3207
Zhuang, B., Ramodiharilafy, R., Liebl, U., Aleksandrov, A. & Vos, M.H. (2022) Ultrafast Photooxidation of Protein-bound Anionic Flavin Radical, Proc. Natl. Acad. Sci. USA 119, e2118924119
Zhuang, B., Nag, L., Sournia, P., Croitoru, A., Ramodiharilafy, R, Lambry, J.-C., Myllykallio, H., Aleksandrov, A., Liebl, U. & Vos, M.H. (2021) Photochemical processes in flavo-enzymes as a probe for active site dynamics: TrmFO of Thermus thermophilus, Photochem. Photobiol. Sci., 20, 663-670
Sorigué, D., Hadjidemetriou, K., Blangy, S., Gotthard, G., Bonvalet, A., Coquelle, N., Samire, P., Aleksandrov, A., Antonucci, L., Benachir, A., Boutet, S., Byrdin, M., Cammarata, M., Carbajo, S., Cuiné, S., Doak, R.B., Foucar, L., Gorel, A., Grünbein, M., Hartmann, E., Hienerwadel, R., Hilpert, M., Kloos, M., Lane, T. J., Légeret, B., Legrand, P., Li-Beisson, Y., Moulin, S., Nurizzo, D., Peltier, G., Schirò, G., Shoeman, R.L., Sliwa, M., Solinas, X., Zhuang, B., Barends, T.R.M., Colletier, J.-P., Joffre, M., Royant, A., Berthomieu, C., Weik, M., Domratcheva, T., Brettel, K., Vos, M.H., Schlichting, I., Arnoux, P., Müller, P. & Beisson, F. (2021) Mechanism and dynamics of fatty acid photodecarboxylase, Science 372, eabd5687
Pirisi, K., Nag, L., Fekete, Z., Iuliano, J.N., Tollentino Collado, J., Clark, I.P., Pécsi, I., Sournia, P., Liebl, U., Greetham, G.M., Tonge, P.J., Meech, S.R., Vos, M.H. & Lukacs, A. (2021) Identification of the vibrational marker of tyrosine cation radical using ultrafast transient infrared spectroscopy of flavoprotein systems, Photochem. Photobiol. Sci. 20, 369-378
Zhuang, B., Seo, D., Aleksandrov, A. & Vos, M.H. (2021) Characterization of Light-Induced Short-Lived Interacting Radicals in the Active Site of Flavoprotein Ferredoxin-NADP+ Oxidoreductase, J. Am. Chem. Soc. 143, 2457-2768
Vos, M.H., Salman, M., Ramodiharilafy, O. & Liebl, U. (2021) Fluorescent iron-sulfur centers: Photochemistry of the PetA Rieske protein from Aquifex aeolicus , Biochim. Biophys. Acta, 1862, 148385
Karadi, K., Kapetanaki, S.M., Raics, K., Pecsi, I., Kapronczai, R., Fekete, Z., Iuliano, J., Tolentino, J., Gil, A., Orban, J., Nyitrai, M., Greetham, G.M., Vos, M.H., Tonge, P.J., Meech, S.R. & Lukacs, A. (2020) Functional dynamics of a single tryptophan residue in a BLUF protein revealed by fluorescence spectroscopy, Sci. Rep. 10, 2061
Salman, M., Villamil Franco, C., Ramodiharilafy, O., Liebl, U. & Vos, M.H. (2019) Interaction of the full-length heme-based CO sensor protein RcoM-2 with ligands, Biochemistry 58, 4028-4034
Nag, L., Lukacs, A & Vos, M.H. (2019) Short-lived radical intermediates in the photochemistry of glucose oxidase, ChemPhysChem 20, 1793-1798
Kapetanaki, S.M., Burton, M.J., Basran, J., Uragami, C., Moody, P.C.E., Mitcheson, J.S., Schmid, R., Davies, N.W., Dorlet, P., Vos, M.H., Storey, N.M. & Raven, E.L. (2018) A mechanistic basis for understanding the interplay of heme and CO in ion channel regulation, Nature Comm. 9, 907 (correction Nature Comm. 9, 3354)
Nag, L., Sournia, P., Myllykallio, H., Liebl, U. & Vos, M.H. (2017) Identification of the TyrOH●+ radical cation in the flavoenzyme TrmFO, J. Am. Chem. Soc. 139, 11500-11505 (correction J. Am. Chem. Soc. 139, 15554)
Vos, M.H., Reeder, B.J., Daldal, F. & Liebl, U. (2017) Ultrafast photochemistry of the bc1 complex; Phys. Chem. Chem. Phys. 19, 6807-6813 (correction Phys. Chem. Chem. Phys. 19, 9320)
Brettel, K, Byrdin, M. & Vos, M.H. (2016) Ultrafast light-induced processes in DNA-photolyase and its substrate-bound complex in Ultrafast Dynamics at the Nanoscale: Biomolecules and Supramolecular Assemblies (Burghardt, I. &Haacke, S., Eds.) Pan Stanford, Singapore, pp. 65-90
Ferrante, C., Pontecorvo, E., Cerullo, G., Vos, M.H. & Scopigno, T. (2016) Direct observation of sub-picosecond vibrational dynamics in photoexcited myoglobin, Nature Chem. 8, 1137-1143
Bouzhir-Sima, L., Motterlini, R., Gross, J., Vos, M.H. & Liebl, U. (2016) Unusual Dynamics of Ligand Binding to the Heme Domain of the Bacterial CO Sensor Protein RcoM-2, J. Phys. Chem. B 120, 10686-10694
Lambry, J.-C., Stranava, M., Lobato, L., Martinkova, M., Shimizu, T., Liebl, U. & Vos, M.H. (2016) Ultrafast spectroscopy evidence for picosecond ligand exchange at the binding site of a heme protein: heme-based sensor YddV, J. Phys. Chem. Lett. 7, 69-74
Fojtikova, V., Stranava, M., Vos, M.H., Liebl, U., Hranicek, J., Kitanishi, K., Shimizu, T. & Martinkova, M. (2015) Kinetic Analysis of a Globin-coupled Histidine Kinase, AfGcHK: Effects of the Heme Iron Complex, Response Regulator and Metal Cations on Autophosphorylation Activity, Biochemistry 54, 5017-5029
Vos, M.H. & Liebl, U. (2015) Time resolved infrared spectroscopic studies of ligand dynamics in the active site from cytochrome c oxidase, Biochim. Biophys. Acta 1847, 79-85
Lobato, L., Bouzhir-Sima, L., Yamashita, T., Wilson, M.T., Vos, M.H. & Liebl, U. (2014) Dynamics of the heme-binding bacterial gas sensing dissimilative nitrate respiration regulator (DNR) and activation barriers for ligand binding and escape, J. Biol. Chem. 289, 26514-26524
Becker, H.F., Djaout, K., Lamarre, I., Ulmer, J.E., Schaming, D., Balland, V., Liebl, U., Myllykallio, H. & Vos, M.H. (2014) Substrate interaction dynamics and oxygen control in the active site of thymidylate synthase ThyX, Biochem. J. 459, 37-45
Laptenok, S.P., Nuernberger, P., Lukacs, A. & Vos, M.H. (2014) Subpicosecond Kerr-gate spectrofluorometry in Methods in Molecular Biology, Fluorescence Spectroscopy and Microscopy: Methods and Protocols , vol. 1076 (Engelborghs, Y. & Visser, A.J.W.G., Eds.), Humana Press, New York, pp. 321-336
Liebl ,U., Lambry, J.-C. & Vos, M.H. (2013) Primary processes in heme-based sensor proteins, Biochim. Biophys. Acta 1834, 1684-1692
Laptenok, S.P., Bouzhir-Sima, L., Lambry, J.-C., Myllykallio, H., Liebl, U., & Vos, M.H. (2013) Ultrafast real time visualization of the active site flexibility of the flavoenzyme thymidylate synthase ThyX, Proc. Natl. Acad. Sci. USA 110, 8924-8929
Silkstone, G., Kapetanaki, S.M., Husu, I., Vos, M.H. & Wilson, M.T. (2012) Nitric oxide binding to the cardiolipin complex of ferric cytochrome c, Biochemistry 51, 6760-6766
Jasaitis, A., Ouellet, H., Lambry, J.-C., Martin, J.-L., Friedman, J.M., Guertin, M. & Vos, M.H. (2012) Ultrafast Heme-Ligand Recombination in Truncated Hemoglobin HbO from Mycobacterium tuberculosis: a Ligand Cage, Chem. Phys. 396, 10-16
Vos, M.H., Bouzhir-Sima, L., Lambry, J.-C., Luo, H., Eaton-Rye, J.J., Ioanoviciu, A., Ortiz de Montellano, P.R. & Liebl, U. (2012) Ultrafast ligand dynamics in the heme-based GAF sensor domains of the histidine kinases DevS and DosT from Mycobacterium tuberculosis, Biochemistry 51, 159-166
Nuernberger, P., Lee, K.F., Bonvalet, A, Bouzhir-Sima, L., Lambry, J.-C., Liebl, U., Joffre ,M. & Vos, M.H. (2011) Strong ligand-protein interactions revealed by ultrafast infrared spectroscopy of CO in the heme pocket of the oxygen sensor FixL, J. Am. Chem. Soc. 133, 17110 –17113
Kruglik, S.G., Lambry, J.-C., Martin, J.-L. Vos, M.H. & Négrerie, M. (2011) Sub-picosecond Raman spectrometer for time-resolved studies of structural dynamics in heme proteins, J. Raman Spectrosc. 42, 265-275
Groma, G.I., Colonna, A, Martin, J.-L. & Vos, M.H. (2011) Vibrational motions associated with primary processes in bacteriorhodopsin studied by coherent infrared emission spectroscopy, Biophys. J. 100, 1578-1586
Kruglik, S.G., Yoo, B.-K., Franzen, S., Vos, M.H., Martin, J.-L. & Négrerie, M. (2010) Picosecond primary structural transition of the heme retarded after nitric oxide binding to heme proteins, Proc. Natl. Acad. Sci. USA, 107, 13678-13683
Nuernberger, P., Lee, K.F., Bonvalet, A, Vos, M.H. & Joffre, M. (2010) Multiply excited vibration of carbon monoxide in the primary docking site of hemoglobin following photolysis from the heme, J. Phys. Chem. Lett. 1, 2077-2081
Rappaport, F., Zhang, J., Vos, M.H., Gennis, R.B., & Borisov, V.B. (2010) Heme-heme and heme-ligand interactions in the di-heme oxygen-reducing site of cytochrome bd from Escherichia coli revealed by nanosecond absorption spectroscopy, Biochim. Biophys. Acta 1797, 1657-1664
Silkstone, G., Kapetanaki, S.M., Husu, I., Vos, M.H. & Wilson, M.T. (2010) Nitric Oxide binds to the proximal heme coordination site of the ferrocytochrome c / cardiolipin complex: formation mechanism and dynamics, J. Biol. Chem. 285, 19785-19792
Byrdin, M., Lukacs, A., Eker, A.P.M., Thiagarajan, V., Brettel, K. & Vos, M.H. (2010) Quantum yield measurements of short-lived photoactivation intermediates in DNA photolyase: towards a detailed understanding of the triple tryptophan electron transfer chain, J. Phys. Chem. A, 114, 3207-3214