Réparation ADN chez les procaryotes
Personnes impliquées:
- Hannu MYLLYKALLIO, DR, CNRS
- Stephane SKOULOUBRIS, MdC, Univ. Paris–Saclay
- Amandine Ignace, AI, CNRS
- Wenlu Yin, Doctorant
Thématique:
Les systèmes de réparation de l’ADN participent au maintien de l’intégrité des génomes et jouent donc un rôle prépondérant au niveau cellulaire et dans la transmission d’un patrimoine génétique fidèle au cours des descendances.
Nous nous intéressons plus particulièrement à une protéine baptisée NucS (également appelée EndoMS dans la littérature). La présence de cette protéine, découverte au laboratoire, est restreinte au monde procaryotique. Elle est retrouvée chez certaines espèces d’Archaea (Crenarcheota et Euryarcheota) et chez de nombreuses bactéries appartenant au large phylum des Actinobacteria (eg. Corynebactéries et Mycobactéries). Elle présente une activité de clivage contre différents substrats d’ADN et est notamment impliquée dans la détection et la réparation de mésappariements.
Un travail est mené actuellement au sein de notre pôle pour comprendre plus en détails le mécanisme impliquant NucS dans cette réparation. Pour cela, deux modèles bactériens sont étudiés au laboratoire : Corynebacterium glutamicum et Mycobacterium smegmatis. Différentes approches interdisciplinaires de Biologie Moléculaire, Génétique, Biochimie, Microscopie et Bioinformatique sont utilisées.
Il a déjà été établi que NucS travaille de concert avec la protéine connue sous le nom de bêta-clamp ou sliding-clamp (ie. PCNA chez les archées et DnaN chez les bactéries). Une partie du projet vise donc à rechercher et caractériser d’autres protéines partenaires impliquées dans cette voie de réparation. Une seconde partie de nos travaux visent également à évaluer l’impact de mutations dans le gène nucS dans l’antibiorésistance détectée chez de nombreux isolats cliniques de l’agent étiologique de la tuberculose, Mycobacterium tuberculosis.
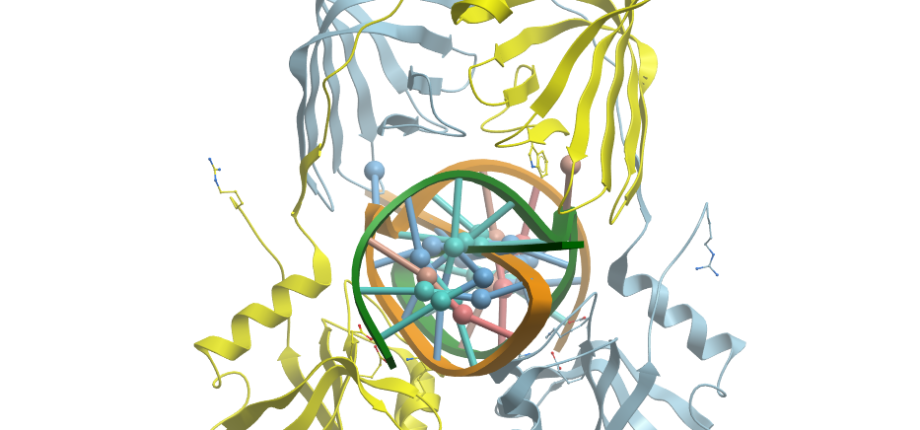
Figure. A) Structure 3D dimérique de la protéine NucS de Thermococcus kodakarensis (PDB : 5GKE ; 5GKJ). La protéine en absence d’ADN adopte une conformation « ouverte » (à gauche) qui se ferme en présence d’un substrat présentant un mésappariement (à droite) (adapté de Nakae et al. (2016). Structure, 24 :1960-71).
-----------------------------------------------
Mots-clés : microbiologie, réparation ADN, mésappariements, NucS, bêta-clamp, C. glutamicum, M. smegmatis, M. tuberculosis, antibiorésistance.
-----------------------------------------------
Publications
Zein-Eddine R, Le Meur A, Skouloubris S, Jelsbak L, Refrégier G, Myllykallio H. NPJ Antimicrob Resist. 2025 Apr 29;3(1):35. https://doi.org/10.1038/s44259-025-00107-1
Ishino S, Skouloubris S, Kudo H, l'Hermitte-Stead C, Es-Sadik A, Lambry JC, Ishino Y, Myllykallio H. Nucleic Acids Res. 2018 Jul 6;46(12):6206-6217. https://doi.org/10.1093/nar/gky460
Rezgui R, Lestini R, Kühn J, Fave X, McLeod L, Myllykallio H, Alexandrou A, Bouzigues C. PLoS One. 2014. Nov 20;9(11):e113493. https://doi.org/10.1371/journal.pone.0113493
Creze C, Ligabue A, Laurent S, Lestini R, Laptenok SP, Khun J, Vos MH, Czjzek M, Myllykallio H, Flament D. J Biol Chem. 2012 May 4;287(19):15648-60. https://doi.org/10.1074/jbc.M112.346361
Creze C, Lestini R, Kühn J, Ligabue A, Becker HF, Czjzek M, Flament D, Myllykallio H. Structure and function of a novel endonuclease acting on branched DNA substrates. Biochem Soc Trans. 2011 Jan;39(1):145-9. https://doi.org/10.1042/BST0390145
Ren B, Kühn J, Meslet-Cladiere L, Briffotaux J, Norais C, Lavigne R, Flament D, Ladenstein R, Myllykallio H. Structure and function of a novel endonuclease acting on branched DNA substrates. EMBO J. 2009 Aug 19;28(16):2479-89. https://doi.org/10.1038/emboj.2009.192
Ren B, Kuhn J, Meslet-Cladiere L, Myllykallio H, Ladenstein R. Acta Crystallogr Sect F Struct Biol Cryst Commun. 2007 May 1;63(Pt 5):406-8. https://doi.org/10.1107/S1744309107015278
Meslet-Cladiére L, Norais C, Kuhn J, Briffotaux J, Sloostra JW, Ferrari E, Hübscher U, Flament D, Myllykallio H. J Mol Biol. 2007. Oct 5;372(5):1137-48. https://doi.org/10.1016/j.jmb.2007.06.056
Collaborations
- Dr Guislaine Refrégier, IDEEV, UniV. Paris-Saclay
- Pr Emmanuelle Cambau, University Paris Cite - APHP (Bichat Claude-Bernard hospital)
- Pr Lars Jelsbak, DTU, Danemark
- Pr Pierre Leblond, Univ. de Lorraine, Nancy
- Didier Flament, IFREMER, Brest
Financements
- ANR-22-CE12-0042 / Avril 2023, durée 48 mois
- ANRS – Maladies infectieuses émergentes Agence autonome de l’INSERM (EMERGENCES N°23534)



